世界のファーマコビジランス&医薬品安全性ソフトウェア市場(2024年~2032年):機能別、他

※本ページに記載されている内容は英文レポートの概要と目次を日本語に自動翻訳したものです。英文レポートの情報と購入方法はお問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
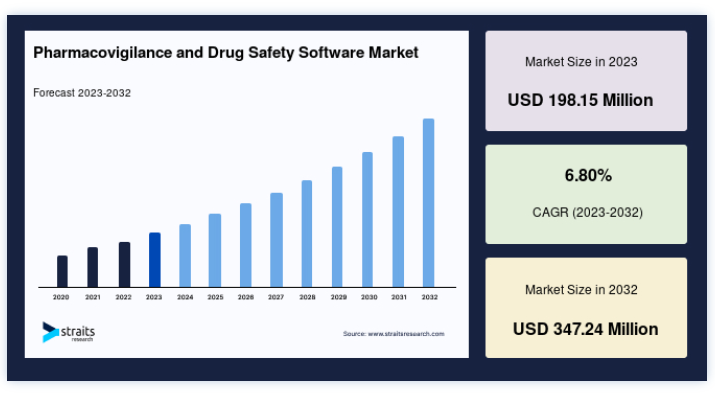
世界のファーマコビジランス&医薬品安全性ソフトウェア市場規模は、2023年には1億9815万米ドルと評価され、予測期間(2024年~2032年)にCAGR 6.80%で成長し、2032年には3億4724万米ドルに達すると予測されている。
ファーマコビジランスとは、データ収集を含む一連の活動を通じて、医薬品の副作用(ADR)、重篤な有害事象(SAE)、または重篤な事象(S.E.s)を検出、評価、理解、予防することです。 ファーマコビジランス&医薬品安全性ソフトウェアは一般的に、医薬品に関する休薬の原因を特定し、将来の不必要な有害事象を防止するために使用されます。 ファーマコビジランス・プロセスの有効性を高め、医薬品の安全性を高めることは、消費者、処方者、メーカーなど、医療プロセスに関わるすべての人にとって有益です。
ファーマコビジランスの目的は、医薬品の有効性の閾値を超える有害事象を評価することである。 言い換えれば、どの副作用が、疾患の治療効果との関係で、患者にとってリスクに見合うものかを判断することである。 例えば、化学療法は非常に重篤な副作用を引き起こすことが知られているが、生命を脅かす癌の前では、患者が治癒する可能性があるため、これらの副作用は許容範囲とみなされる。 しかし、頭痛の治療に使用される薬剤が同様の副作用をもたらした場合、患者にとってのリスクは高すぎると判断され、潜在的な利益はリスクを正当化するのに十分ではないだろう。
世界のファーマコビジランス&医薬品安全性ソフトウェア市場の促進要因
医薬品副作用の増加
薬物有害反応(ADR)は、特に治療法の複雑化、人口の高齢化、複数の疾患の有病率の上昇を考慮すると、現代の医療における課題として残っている。 薬物の副作用は薬物療法に不可欠な要素です。 これらの副作用は、人身傷害、病院の過密化、医療費の増大を招き、国の医療制度に大きな負担をかける。 世界的な調査によれば、全入院患者の3〜7%が薬剤副作用(ADR)の結果であり、入院患者の10〜20%が薬剤関連の副作用を経験している。 重篤なADRは、米国では入院患者の死亡原因の第4位から第6位を占め、入院期間の長期化と治療費の倍増を招いている。 したがって、ADRの早期発見と予防は、医療チームと患者が共有する目標である。 したがって、医薬品副作用の事例の増加は、世界市場の需要を増加させるだろう。
医薬品開発に対する厳しい規制
欧州医薬品庁(European Medicines Agency)や米国食品医薬品局(U.S. Food and Drug Administration)のような政府機関から安全性ガイドラインを遵守するようプレッシャーをかけられていることが、ファーマコビジランス・システムの導入が進む要因となっている。 2021年は、COVID-19の結果、医薬品のサーベイランスを担当する関連当局や国際機関内で、大きな熱気と議論、再編成が行われた。 この1年を通じて、多くのファーマコビジランス・ガイドラインが見直され、承認され、発表された。 欧州医薬品庁(EMA)による「リスク最小化対策-ツールおよび効果指標の選択」に関するモジュールXVIの第3次改訂版およびその補遺である「効果評価の方法」に関するパブリックコンサルテーションが開催された。
市場阻害要因
認識不足
患者は有害事象に気づかないため、一貫性のない報告が行われる(A.E.)。 通常、患者は不安になり、あらゆる症状を有害事象(A.E.)として報告する。 しかし、報告された有害事象(A.E.)が必ずしもすべて重篤なものとは限らないため、製薬会社の委員会は医薬品の回収につながる判断を誤らざるを得ない。 中低所得国では、こうした専門的なサービスに必要なソフトウェア、サービス、トレーニングが不足している。 政府や製薬会社も、A.E.報告の推進にあまり力を入れていない。 これらの問題は、中低所得国におけるファーマコビジランス市場の成長を制限すると予想される。
市場機会
ファーマコビジランスに関する政府政策の増加
世界各国の政府は、医薬品の副作用報告とファーマコビジランスを促進する政策を実施している。 インドのファーマコビジランス・プログラムのナショナル・コーディネーション・センター(NCC)として機能しているインド薬局方委員会は、医薬品の安全使用の奨励(PvPI)を優先している。 現在、179の医薬品副作用(ADR)モニタリング施設がNCCにADRを報告している。 患者の安全性を向上させるために、NCC は、モニタリングとサーベイランスの能力を高め、ADR 報告を増やすために他の国家保健プログラムや組織と協力し、PvPI がインドの規制当局にとって不可欠な知識レポジトリとして機能するようにするなど、多くの措置を講じている。 例えば、米国政府のOpen FDAイニシアチブは、オープンな検索ベースのプログラムを通じて、アプリケーション開発者や科学者がFDAのデータベースにアクセスできるようにしている。 また、Mini-Sentinelと呼ばれるプロジェクトは、適切な統計データをより迅速に提供することで、アクティブサーベイランスシステムをサポートするために米国で開始された。
地域別インサイト
北米: 市場シェア5%で圧倒的な地域
北米は世界市場への貢献度が最も高く、予測期間中に年平均成長率5%で成長すると予測されている。 さらに、過去20年間に慢性疾患の有病率が上昇したことで、治療法を見つけるための研究開発需要が高まっている。 がん患者の増加は、この地域における切実な懸念である。 例えば、国立ケア研究所によると、米国では2018年に170万人以上のがん患者が新たに登録された。 一方カナダでは、2017年のカナダがん協会によると、206,200件以上のがんが新たに登録されたと推定されている。
アジア太平洋地域: 最もCAGRの高い急成長地域
欧州は2番目の主要地域であり、CAGR 6.2%で成長すると予測されている。 これは、てんかん、統合失調症、双極性障害、てんかん発作などの神経疾患を含むいくつかの慢性疾患の治療法を見つけるための、製薬・バイオテクノロジー業界による研究・開発活動の増加に起因している。 例えば、てんかん患者数は50万人を超え、1日の発症率は約87人である(Epilepsy Society)。 さらに、欧州全体では、心血管疾患や関節炎を含む他の重篤な疾患の発生率が上昇しており、世界市場の需要を押し上げる可能性が高い。
アジア太平洋地域は、老人人口の増加と慢性疾患の有病率の増加により、世界市場で著しい成長を遂げています。 中国は、ファーマコビジランスの継続的な発展、老人人口、慢性疾患の有病率の結果として、ファーマコビジランス&医薬品安全性ソフトウェア市場で急速な成長を経験している。 消化器疾患、がん、神経疾患などの慢性疾患や重篤な疾患を治療するため、多くの日本企業が研究開発に多額の投資を行っている。 現在、日本ではこれらの疾患の治療薬として複数の医薬品が開発中である。
LAMEA地域は世界市場で台頭しつつある。 これは、同地域で研究・開発活動が活発化しているためである。 さらに、アフリカ市場は、貧弱な医療インフラとこの地域の経済成長の低迷の結果、成長のペースアップに苦労している。 アブダビ保健省は2022年6月30日、「医療情報セキュリティとサイバーセキュリティ基準のためのアブダビ基準」を発表した。 同サーキュラーは、保健省からライセンスを取得しているすべての医療・製薬施設(以下、「ライセンス事業者」)に対し、同基準に沿った運用を行っていることを証明する「安全な」または「安全な」証明書の取得を義務付けている。 許可事業者は、2022年12月31日までに、基準への自己適合を確認するための監査プロセスを終了しなければならない。
ファーマコビジランス&医薬品安全性ソフトウェアの市場細分化分析
機能別
市場は有害事象報告ソフトウェア、医薬品安全性監査ソフトウェア、問題追跡ソフトウェア、完全統合ソフトウェアに二分される。 これは、重篤な有害事象、重篤な臨床試験、非重篤な医薬品副作用、医療関連製品情報を監視・追跡する能力に起因している。 さらに、臨床試験の増加や、欧州医薬品庁(European Medicines Agency)や米国食品医薬品局(U.S. Food & Drug Administration (FDA))などの政府当局による安全性ガイドラインの遵守・順守に対する圧力の高まりが、医薬品安全性監査ソフトウェアの採用拡大に寄与すると予想される。 医薬品安全性監査ソフトウェア分野は、2014年に6,836万米ドルと評価された。
完全に統合されたソフトウェアセグメントは、技術の開始以来、より高いCAGRを目撃することが期待されている。 これは、エラーを排除してデータの冗長性を回避し、個々の症例の安全性報告を追跡する精度に起因している。 さらに、ファーマコビジランスとデータ安全性ソリューションのための完全統合型ソフトウェアに対する世界的な需要の増加が、市場の成長をサポートすると予想される。 完全に統合されたソフトウェアセグメントは、2014年に1,382万米ドルと評価され、2019年末までに1,499万米ドルに達する可能性が高い。
提供形態別
市場は、オンプレミス配信とオンデマンド/クラウドベース(SAAS)配信に二分される。 オンプレミス・デリバリー分野は市場への貢献度が最も高く、より多くの大手製薬企業が採用していることから、予測期間中に健全なCAGRで成長すると予想されている。 組織内のコンピュータにサービスやソリューションをインストールするのが、このデリバリー・モードである。 しかし、離れた場所からアクセスできるため、低コストでデータ・セキュリティが向上するという利点がある。
オンデマンド/クラウドベース(SAAS)のデリバリー・セグメントは大きな成長が見込まれている。 今後数年間は、クラウドベースのSaaSソリューションのようなオンデマンドソリューションの人気が高まると予想される。 このセグメントを牽引しているのは、製薬会社や医薬品開発業務受託機関において、こうしたプラットフォームの採用が拡大していることである。 クラウドベースのシステムの利点には、拡張性、リアルタイムのデータ追跡、データへのリモートアクセスなどがある。
エンドユーザー別
市場は、製薬・バイオテクノロジー企業、医薬品開発業務受託機関、ビジネスプロセスアウトソーシング企業、その他のファーマコビジランスサービスプロバイダーに二分される。 製薬企業およびバイオテクノロジー企業のセグメントは、市場への貢献度が最も高く、予測期間中に健全なCAGRで成長すると予想されています。 製薬企業やバイオテクノロジー企業は、臨床試験プログラムを合理化し、医療の財政負担を軽減するために、ファーマコビジランスや医薬品安全性ソフトウェアソリューションを広く受け入れている。 その結果、このセグメントが2021年のファーマコビジランス・医薬品安全性ソフトウェア市場を支配した。 ファーマコビジランス・アウトソーシングのトレンドが高まっている結果、メーカーは、完全に統合された製薬会社から徐々にサービスプロバイダーとの費用分担契約に移行することで、運用コストを削減し、コストを抑制するさまざまな方法を模索している。 このため、製薬会社からこれらの業務を受託する企業の拡大が加速すると予想される。
コンタクト・リサーチ機関部門は著しい成長が見込まれる。 ファーマコビジランス・サービス・プロバイダーは、持続可能性を確保するために、専門的なエンド・ツー・エンドのソリューションを消費者に提供している。 これらの事業者はまた、様々な業界からのデータを集約し、リスク評価を可能にするために、電子データ収集のような統合技術を導入している。
ファーマコビジランス&医薬品安全性ソフトウェア市場のセグメンテーション
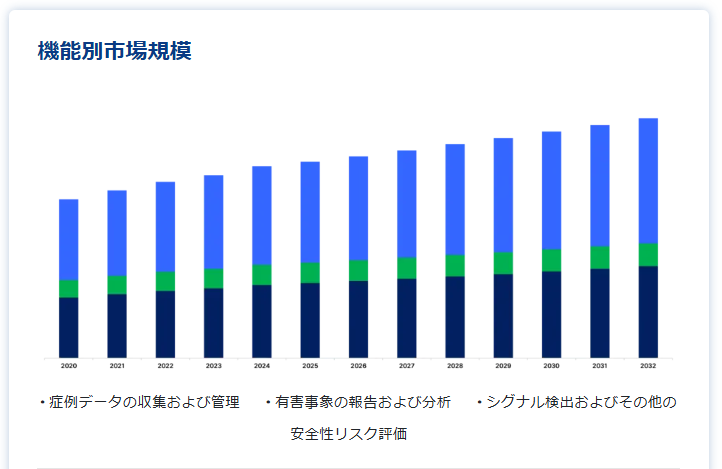
機能別(2020年〜2032年)
症例データの収集と管理
有害事象の報告と分析
シグナル検出とその他の安全性リスク評価
提供形態別(2020~2032年)
オンプレミス
オンデマンド
エンドユース別 (2020-2032)
ヘルスケア企業
CRO/BPO/PVサービスプロバイダー
その他
目次
1. エグゼクティブサマリー
2. 調査範囲とセグメンテーション
3. 市場機会の評価
4. 市場動向
5. 市場の評価
6. 規制の枠組み
7. ESGの動向
8. 世界のファーマコビジランス&医薬品安全性ソフトウェア市場規模分析
9. 北米のファーマコビジランス&医薬品安全性ソフトウェア市場分析
10. ヨーロッパのファーマコビジランス&医薬品安全性ソフトウェア市場分析
11. APACのファーマコビジランス&医薬品安全性ソフトウェア市場分析
12. 中東・アフリカのファーマコビジランス&医薬品安全性ソフトウェア市場分析
13. ラタムのファーマコビジランス&医薬品安全性ソフトウェア市場分析
14. 競合情勢
15. 市場プレイヤーの評価
16. 調査方法
17. 付録
18. 免責事項
*** 本調査レポートに関するお問い合わせ ***
